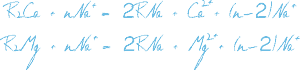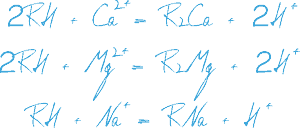Технологии ионного обмена
Умягчение, обессоливание и селективное удаление различных ионов из воды.
В технологии водоподготовки, на ряду и в сочетании с технологиями нанофильтрации и обратного осмоса, применяются два основных процесса для удаления из воды ионизированных примесей: катионирование и анионирование.
В зависимости от обменного иона процессы и аппараты называют: натрий-катионирование (натрий-хлор-ионирование), натрий-катионитный фильтр; H (водород)-катионирование, H-катионитный фильтр; OH-анионирование, OH-анионитный фильтр. Соответственно называется фильтрат, полученный в этих процессах: Na-катионированная вода, H-катионированная вода, OH-анионированная вода и т.п.
Процессы Na-катионирование имеет самостоятельное значение и используется для умягчения воды, в то время как процессы H- и OH-ионирование реализуются совместно в схемах обессоливания воды. Н-катионирование может осуществляться в схемах H-Na-катионирования воды.
Процессы ионирования воды на водоподготовительных установках реализуются в напорных насыпных ионитных фильтрах раздельного и смешанного действия.
Для быстрого перемещения между категориями воспользуйтесь рубрикатором
УМЯГЧЕНИЕ ВОДЫ Na-КАТИОНИРОВАНИЕМ
Процесс Na-катионирования применяют для умягчения воды путем фильтрования ее через слой катионита в натриевой форме. При этом ионы Ca2+ и Mg2+, обуславливающие жесткость исходной воды, задерживаются катионитом в обмен на эквивалентное количество ионов Na2+.
Процесс ионного обмена при натрий-катионировании воды:
Где:
R - матрица с фиксированными зарядами без обменного иона, считающаяся одновалентной.
Остаточная жесткость фильтра при одноступенчатом Na-катионировании может быть получена при надлежащих условиях регенерации фильтра на уровне 10 - 20 мкг-экв/л, что является определяющим при реализации этого процесса.
Анионный состав Na-катионированной воды остается неизменным, поэтому карбонатная жесткость исходной воды переходит в гидрокарбонат натрия (NaHCO3).
Образование гидрокарбоната натрия при умягчении (Na-катионировании) воды:
Где:
R - матрица с фиксированными зарядами без обменного иона, считающаяся одновалентной.
Гидрокарбонат натрия, при нагревании воды более 80ОC, превращается в конечном итоге в гидроксид натрия по реакциям:
который может инициировать щелочную коррозию.
Неизменность величины щелочности при Na-катионировании является основным недостатком этого процесса (применительно к подготовке воды для теплоэнергетики), поэтому он может иметь самостоятельное значение только при подготовке воды для подпитки теплосети и добавочной воды для котлов низкого и среднего давлений при сравнительно низкой щелочности исходной воды.
Второй недостаток рассматриваемой технологии определяется увеличением солесодержания фильтрата при выражении его в массовых единицах, что связано с эквивалентными массами ионов Na+ (23 единицы), Ca2+ (20 единиц) и Mg2+ (12 единиц). Напомним, что ионный обмен характеризуется эквивалентностью, поэтому из воды удаляются ионы с меньшей эквивалентной массой (Ca2+, Mg2+), а их место занимает ион натрия с большей эквивалентной массой.
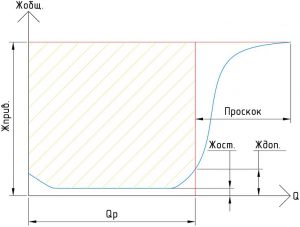
Процесс умягчения при Na-катионировании заканчивается при наступлении проскока жесткости, после чего истощенный катионит в фильтре надо регенерировать, т.е. восстанавливать его способность к обмену ионами.
Кривая качества фильтрата при натрий-катионировании, определяющая величину фильтроцикла - QP (М3):
Где:
Жприв. - жесткость исходной (приводной) воды (мг-экв./л);
Жост. - остаточная жесткость фильтрата на протяжении всего фильтроцикла (мг-экв./л);
Ждоп. - максимальная допустимая остаточная жесткость фильтрата (мг-экв./л).
Регенерацию истощенного катионита проводят пропуском через него 6 - 10% раствора NaCl (например поваренная соль). Вследствие относительно большой концентрации ионов Na+ в регенерационном растворе происходит замена ими поглощенных ранее катионов Ca2+ и Mg2+.
Процесс восстановления обменной способности катионита в натрий-форме:
Где:
R - матрица с фиксированными зарядами без обменного иона, считающаяся одновалентной;
n - избыток NaCl против его стехиометрического расхода.
Несмотря на то, что процесс обмена ионов, в том числе и при регенерации ионита, характеризуется эквивалентностью, для качественной регенерации ионитов расход реагента выбирается с определенным избытком (n).
При подаче раствора соли в фильтр лучше будет отрегенерирован лобовой катионита, контактирующий со свежим раствором. По мере прохождения раствора в глубинные части катионита условия регенерации будут ухудшаться вследствие повышения концентрации в регенерационном растворе ионов Ca2+ и Mg2+, вытесненных из верхних слоев катионита при обеднении регенеранта ионами Na+. Аналогичное действие проявляется за счет загрязнения раствора технической соли ионами Ca2+ и Mg2+.
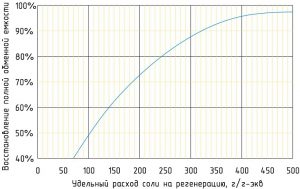
На практике расход соли на регенерацию принимают в пределах 120 - 150 г/г-экв по экономическим и экологическим соображениям, поэтому рабочая обменная емкость не достигает значения полной. Ограничение расхода соли позволяет уменьшить ее количество в сточных регенерационных водах. Эффект прироста обменной емкости с увеличением удельного расхода более 300 г/г-экв заметно снижается.
Зависимость восстановления обменной емкости натрий-катионитовой установки от удельного расхода соли на регенерацию:
Эффект регенерации катионита при выбранном расходе реагента повышается с увеличением продолжительности контакта раствора соли с катионитом, поэтому скорость пропуска регенерационного раствора ограничивают пределами 4 - 6 м/ч. Скорость ниже 4.0 м/ч не используется по гидродинамическим условиям работы фильтра.
Регенерацию ионита в фильтрах можно проводить несколькими способами, которые отличаются друг от друга направлениями потоков обрабатываемой воды и регенерационного раствора. При совпадении направлений потока воды и регенерационного раствора, подаваемых обычно сверху - вниз, регенерацию называют параллельно-точной, такая регенерация создает не самые оптимальные условия для процесса умягчения из-за распределения ионов Na+ и ионов жесткости в слое отрегенерированного материала. На выходе из слоя катионита умягчаемая вода, в которой резко снижена концентрация ионов жесткости, проходит через участки плохо отрегенерированного катионита и поэтому не может глубоко умягчаться. Кроме того, такое обстоятельство может привести к переходу некоторой части ионов жесткости из катионита в воду.
При противоточной регенерации регенерационный раствор подается в направлении, противоположном подаче потока обрабатываемой воды, при этом наиболее полно регенерируются выходные (по воде) слои катионита. Это позволяет не только сохранить постоянное значение остаточной концентрации ионов в фильтрате, но и получить фильтрат более высокого качества при сниженных избытках реагента и, следовательно, меньших объемах сточных вод.
Эффективная противоточная технология позволяет сократить количество ступеней очистки воды за счет повышения качества фильтрата. К недостатку противоточной регенерации относится усложнение конструкции фильтра, связанное с недопущением перемешивания слоев ионита при подаче раствора или воды в нижнюю часть фильтра.
Для сокращения расхода реагентов с использованием параллельно-точной технологии регенерации применяют двухступенчатую схему Na-катионирования, т.е. последовательное включение двух фильтров. Фильтр первой ступени регенерируется с относительно наибольшем избытком NaCl (n = 1.8 - 2.4), поэтому остаточная жесткость фильтрата получается высокой, на уровне 0.1 мг-экв/л. Фильтр второй ступени регенерируется с 6.5 - 7.5-кратным избытком соли, поэтому остаточная жесткость воды снижается со 100 до 5 - 10 мкг-экв/л.
Технико-экономические расчеты показывают, что, несмотря на увеличение количества фильтров в двухступенчатой схеме, последняя имеет преимущества перед одноступенчатой схемой за счет снижения расхода соли при равноценном качестве умягченной воды.
H-КАТИОНИРОВАНИЕ
Обработка воды методом H-катионирования предназначается для удаления всех катионов из воды с заменой их на ионы водорода. Вода за H-катионитными фильтрами содержит избыток ионов водорода и вследствие этого имеет кислую реакцию, поэтому эта технология применяется совместно с другими процессами ионирования - Na-катионированием (умягчением) или анионированием.
Процесс ионного обмена при H-катионировании воды:
Где:
R - матрица с фиксированными зарядами без обменного иона, считающаяся одновалентной.
Выделяющиеся ионы водорода (H+) в свою очередь реагируют в обрабатываемой воде с гидрокарбонатными ионами:
Остаточная кислотность фильтрата после завершения реакции с учетом равенства эквивалентных концентраций катионов и анионов будет равна:
Приведенные выше реакции позволяют контролировать полноту обмена ионов при H-катионировании по кислотности и по известным показателям качества поступающей на установку воды. При наличии в исходной воде ионов NO3- и NO2- они также должны быть учтены в расчетной оценке кислотности H-катионированной воды.
Сорбция катионов Ca2+, Mg2+ и Na+ ионитом осуществляется в соответствие с расположением этих ионов в ряду селективности (кальций > магний > натрий), поэтому в слое H-катионита сверху располагается зона поглощения иона Ca2+, ниже - иона Mg2+ и далее - иона Na+. Эти три зоны по мере истощения H-катионита передвигаются одна за другой по направлению к нижней границе слоя ионита и первым обнаружится проскок иона Na+.
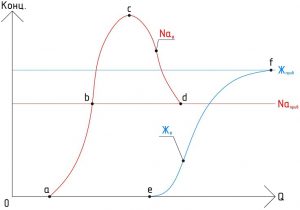
Графики изменения качества фильтрата при H-катионировании воды, при истощении катионита:
Где:
Q - объем фильтрата (м3);
Жприв - величина жесткости (Ca2++Mg2+) в приводной (исходной) воде;
Naприв - содержание натрия (Na+) в приводной (исходной) воде;
Жф - содержание солей жесткости (Ca2++Mg2+) в фильтрате;
Naф - содержание натрия (Na+) в фильтрате;
a - начало проскока натрия (Na+) в фильтрате;
b - отсутствие поглощения катионитом натрия (Na+);
c - максимум вытеснения натрия (Na+) из катионита;
d - окончание вытеснения натрия (Na+) из катионита;
e - начало проскока солей жесткости (Ca2++Mg2+) в фильтрате;
f - полное истощение H-катионита.
Полное поглощение всех катионов (диапазон 0 >> a). Фильтрат имеет кислотность, равную (СCl- + СSO42-)прив. Появление нарастающей концентрации иона Na+. В этот период концентрация иона Na+ постепенно возрастает, а кислотность начинает снижаться за счет уменьшения количества вытесняемых ионов H+. К моменту достижения начального содержания иона Na+ в исходной воде его поглощение прекращается (точка - b), но происходит обмен в катионите ионов Ca2+ и Mg2+ исходной воды на сорбированный катионитом ион Na+ до его полного вытеснения (точка - d). В этот момент (точка - e) появляется проскок жесткости.
Параллельно с указанными выше изменениями концентрации катионов кислотность фильтрата после проскока ионов Na сначала уменьшается и достигает нуля, затем появляется возрастающая щелочность, достигающая исходных значений при обмене ионов Ca2+ и Mg2+ на Na+.Эффект умягчения воды при H-катионировании обычно столь же полный, как и при Na-катионировании.
Работа фильтра до проскока ионов Na+ или ионов жесткости зависит от технологической схемы его использования, соответственно изменяется его рабочая обменная емкость при работе до проскока ионов Na+ или проскока жесткости.
Для регенерации истощения H-катионита по технико-экономическим соображениям чаще используется серная (H2SO4) концентрацией 1.0 - 1.5%, реже для регенерации применяется соляная кислота (HCl) концентрацией 5 - 7 %. Скорость пропуска регенерационного раствора составляет 8 - 10 м/ч для раствора серной кислоты (H2SO4) и 5 - 7 м/ч для раствора соляной кислоты (HCl).
Процесс регенерации H-катионита характеризуется следующими реакциями:
Где:
R - матрица с фиксированными зарядами без обменного иона, считающаяся одновалентной;
n - избыток кислоты против её стехиометрического расхода.
Более низкие концентрации серной кислоты и более высокие скорости пропускания регенерационного раствора, по сравнению с соляной кислотой, обусловлены возможностью выделения на зернах регенерируемого катионита трудно растворимого CaSO4, то есть его загипсовывания.
Расход реагента существенно снижается, а качество фильтрата повышается при применении противоточной регенерации ионитного фильтра. Однако применение фильтров с противоточной регенерацией усложняет конструкцию H-катионитовой установки и требует строгого контроля за скоростями потоков на всех стадиях регенерации фильтра.
Расход реагентов на регенерацию сильнокислотных катионитов и применение аппаратов с прямоточной и противоточной регенерацией:
| ПРИМЕНЕНИЕ | СЕРНАЯ КИСЛОТА | СОЛЯНАЯ КИСЛОТА |
| Первая ступень H-катионирования (прямоток) | 50-100 г/л | 40-80 г/л |
| Вторая ступень H-катионирования (прямоток) | 50 г/л | 40 г/л |
| Третья ступень H-катионирования (прямоток) | 80-100 г/л | 80-100 г/л |
| Сорбция катионов на одной ступени H-катионирования (противоток) | 35-50 г/л | 30-50 г/л |
| Очистка турбинного конденсата (противоток) | 100-200 г/л | 100-150 г/л |
Расход серной (соляной) кислоты на регенерацию карбоксильных катионитов определяют из расчета близкого к стехиометрическому (1,05-1,20 г-экв/г-экв).
АНИОНИРОВАНИЕ
OH-анионирование воды ведется с целью замены удаляемых анионов на ион гидроксила. При сочетании ОН-анионирования с Н-катионированием происходит удаление из воды как анионов, так и катионов в обмен на ионы ОН- и Н+, то есть осуществляется химическое (ионитное) обессоливание воды.
Процесс ионного обмена при OH-анионировании воды:
Где:
R - матрица с фиксированными зарядами без обменного иона, считающаяся одновалентной.
Высокое значение pH в зоне обмена на анионите способствует диссоциации слабых кислот H2CO3 и H2SiO3 и переводу их в ионизированное состояние, поэтому они также могут участвовать в реакциях анионного обмена, но лишь при использовании сильноосновных анионитов.
Процесс диссоциации слабых кислот при использовании сильноосновных анионитов:
Где:
R - матрица с фиксированными зарядами без обменного иона, считающаяся одновалентной.
С учетом значений обменных емкостей слабоосновных и сильноосновных анионитов (EАН ≥ EАВ), а также способности только последних сорбировать анионы слабых кислот, схемы химического обессоливания обычно включают две ступени анионирования: на первой в фильтры загружается слабоосновный анионит, удаляющие ионы SO42- и Cl-; на второй ступени в фильтры загружается сильноосновный анионит, предназначенный главным образом для обескремнивания воды.
Регенерация анионитных фильтров производится раствором NaOH концентрацией 2-4%, со скоростью пропускания 4-5 м/ч.
Процесс восстановления обменной способности анионита в OH-форме:
Где:
R - матрица с фиксированными зарядами без обменного иона, считающаяся одновалентной;
n - избыток NaOH против его стехиометрического расхода.
Избыток щелочи (n) при регенерации слабоосновных анионитов при поглощении ими анионов сильных кислот достаточен в двукратном размере против стехиометрического количества, т.е. 80 г/г-экв. Для регенерации анионита, насыщенного анионами кремниевой кислоты, требуется повышенный избыток NaOH (n = 10 - 20), обеспечивающий последующее кремнесодержание фильтрата на уровне 0.1 мг/л.
Для снижения удельного расхода щелочи регенерацию параллельно-точных анионитных фильтров первой и второй ступеней проводят последовательно, либо используют противоточную или ступенчато-противоточную технологию.
При проектировании технологии химического обессоливания учитывают, что наличие в H-катионированной воде свободной углекислоты, более сильной, чем кремниевая, уменьшает кремнеемкость анионита и вызывает более ранний проскок ионов HSiO3- в фильтрат. Поэтому перед поступлением H-катионированной воды на слой сильноосновного анионита из нее необходимо возможно более полно удалить CO2, для чего в схему включается декарбонизатор.
Еще сильнее снижает кремнеемкость анионита наличие в H-катионированной воде ионов Na+, так как помимо истощения анионита анионами, уравновешивающими эти катионы, увеличивается концентрация в фильтрате противоионов (OH-), что резко ухудшает глубину обескремнивания воды.
С учетом приведенных выше фактов, как правило, используются двухступенчатые схемы обессоливания. Они обеспечивают высокое качество обработанной воды, отвечающее эксплуатационным нормам питательной воды барабанных котлов сверхвысокого давления.
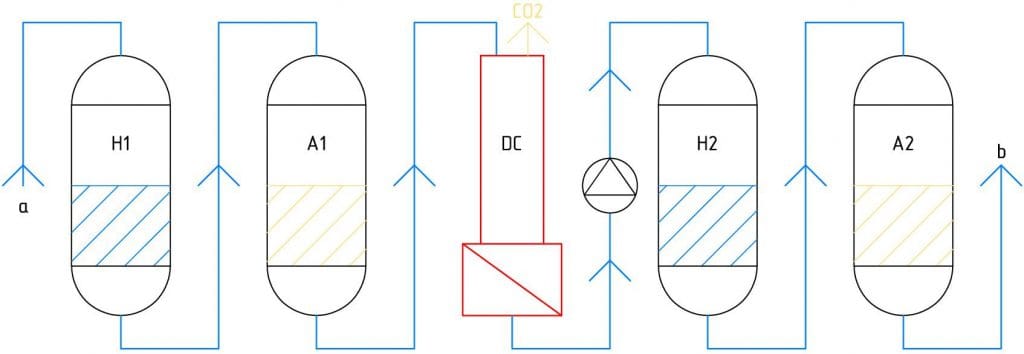
Принципиальная схема двухступенчатого химического обессоливания:
Где:
a - приводная (исходная) вода;
b - обессоленный фильтрат;
H1 - Н-катионитный фильтр первой ступени;
A1 - анионитный фильтр первой ступени (низкоосновный анионит);
DC - декарбонизатор;
H2 - Н-катионитный фильтр второй ступени;
A2 - анионитный фильтр первой ступени (высокоосновный анионит).
Для подготовки добавочной воды для прямоточных котлов и ядерных реакторов применяются трехступенчатые схемы химического обессоливания, в которых в качестве третьей ступени используются фильтры смешанного действия (ФСД). Загрузка ФСД состоит из смеси (от два к одному, до один к двум) сильнокислотного катионита а Н-форме и сильноосновного анионита в OH-форме.
Переходящие в раствор в процессах ионного обмена на чередующихся зернах катионита и анионита ионы H+ и OH- образуют воду, выводя из зоны ионного обмена противоионы, способствуя этим углублению степени обессоливания воды до остаточной удельной электропроводимости менее 0.2 мкСм/см.
Недостаток технологии ФСД заключается в необходимости тщательно перемешивать и разделять (при регенерации) составные части смешанной загрузки.